利用OD600测定抗生素的最小抑菌浓度(MIC)
当前抗生素耐药性危机日益加剧,确定抗生素的最小抑菌浓度(MIC)对于确保抗微生物治疗的有效性愈发重要。MIC 定义为抑制微生物生长的最低抗生素浓度,是剂量研究和抑制耐药菌株出现的研究中必不可少的参数。
酶标仪可用于通过 OD600 测量来测定少量样本中的 MIC。OD600 测量是一种快速、无损的方法,可定量测定微生物的生长。随着细菌生长,光散射强度因细胞数量增加而增强(图1)。OD600实际上是通过检测光的散射(即透射率的下降)来间接反映菌体浓度,而不是传统意义上的吸光度,因为大多数细菌在600 nm波长几乎不具有实际吸收性。借助OD600读数,可以明确区分不同浓度下的抗生素是否能有效抑制微生物的生长。
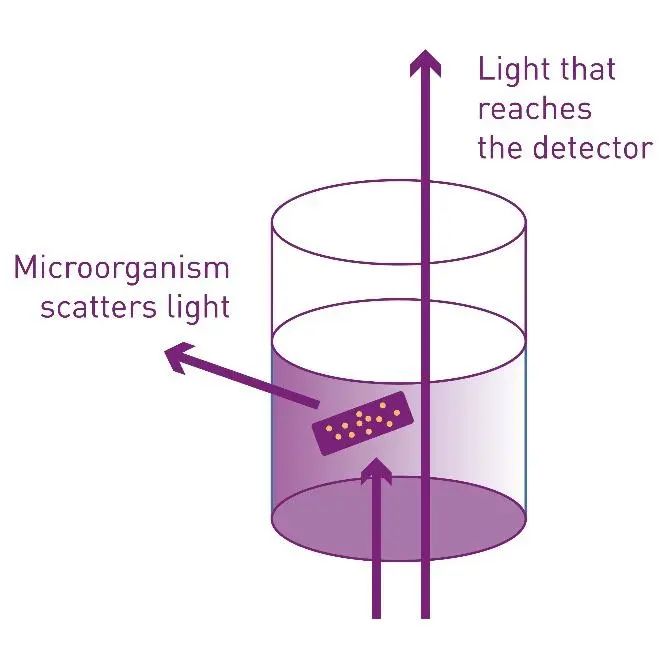
图 1:OD600 测量的检测原理
使用酶标仪(microplate)进行MIC测定显著提高了实验通量,因为可同时进行多组梯度稀释和重复实验。这种高通量特性不仅减少了数据波动性,还大幅降低了人工读取带来的时间和劳动成本,从而提升数据的稳健性与可重复性。此外,自动化的数据采集流程避免了传统目测MIC方法中的主观判断,提高了实验准确性。
在本应用实例中,我们展示了如何使用酶标仪,通过OD600读数来实现抗生素MIC的自动化测定。
实验方法
将大肠杆菌(Escherichia coli, E. coli)培养物解冻后,于37°C条件下在200 mL Luria-Bertani(LB)肉汤中培养18小时。取100 µL菌液加入50 mL新鲜LB肉汤中,制备E. coli工作液。
将庆大霉素(Gentamicin)与氨苄西林(Ampicillin)分别溶解于无菌水中,经0.22 µm孔径滤膜过滤灭菌后,在LB肉汤中稀释制备抗生素母液。随后进行两倍梯度稀释,每种抗生素梯度中的100 µL液体转移至96孔板中(每组设4个重复孔)。再加入100 µL E. coli工作液至各孔中。抗生素的最终浓度范围为0.1–50 µg/mL(见图2)。
作为阳性生长对照(Growth Control, GC),取100 µL E. coli菌液与100 µL LB肉汤混合。空白对照孔(Blank, B)仅加入200 µL LB肉汤,代表检测背景。
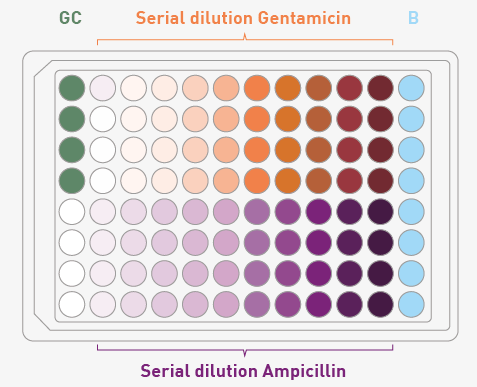
图 2:使用酶标仪测定 MIC 的板布局。
使用带冷凝环的微孔板盖覆盖96孔板后,在VANTAstar酶标仪中对样本进行OD600动态监测,为期12小时。实验设置如下:
- 培养温度:37°C
- OD600检测波长:600 nm
- 每5分钟检测一次
- 每孔检测闪光数:22次
- 稳定时间:0.1 秒
- 扫描模式:3 mm螺旋扫描
- 每次读取间,96孔板以900 rpm的双轨道模式摇匀
未添加抗生素物质、仅含有大肠杆菌的 GC 孔随时间推移,OD600 值显著增加。培养物表现出典型的生长迟缓期。与抗生素处理过的样品相比,OD600 值随时间推移逐渐降低,降低幅度与所用抗生素浓度成正比(图 3)。
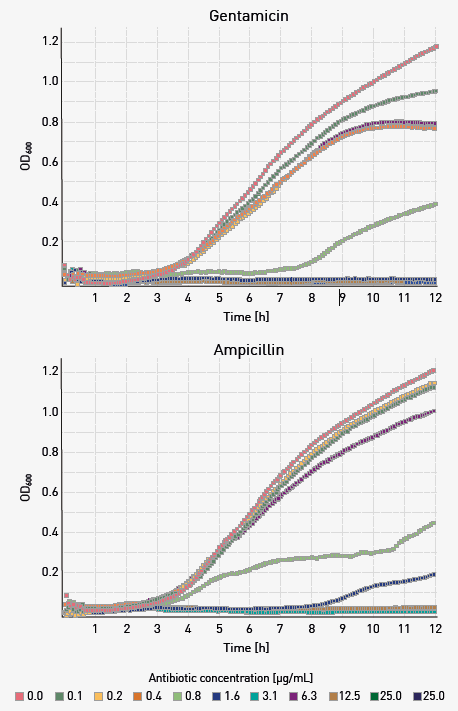
图3:添加庆大霉素或氨苄西林后E. coli的OD600动态变化曲线(12小时),所有OD600读数均经空白对照校正并进行了平滑处理。
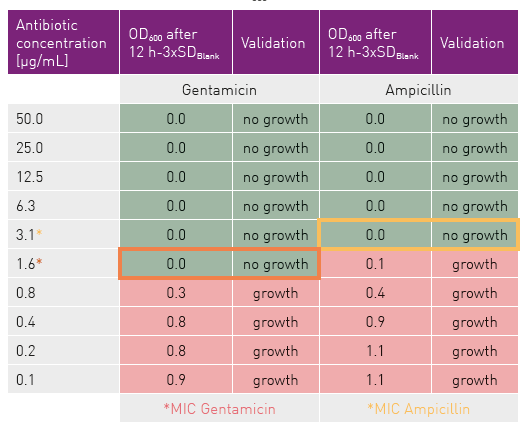
在12小时孵育后,通过比较各孔OD600值,判定是否存在细菌生长。凡OD600值超过空白孔平均值的3个标准差(SD)者,判定为生长阳性(见表1),据此确定MIC值。
表 1:根据 12 小时后的 OD600 值对有无生长的大肠杆菌样品进行分类
结论
总而言之,在酶标仪上测量 OD600 值是一种快速、可靠且客观的方法,可用于测定抗生素物质的 MIC 值。配备 紫外可见光测量选项的酶标仪可同时测定多个样品中的细菌生长情况,从而为测定 MIC 提供了一种实时、免操作的解决方案。BMG LABTECH 读数器允许微生物在 65°C 的温度范围内生长。使用可选的 大气控制单元 (ACU),还可以评估包括对培养环境中氧气和二氧化碳气体浓度有特殊要求的苛刻微生物在内的微生物。
此外,BMG配套的MARS数据分析软件可通过预设模板自动识别是否存在菌落生长,简化后续MIC值的判定流程,避免人工主观分类误差,提高分析效率。
References
-
World Health Organization, Fact sheet, Antimicrobial resistance, www.who.int/news-room/fact-sheets/detail/antimicrobial-resistance.
-
Kowalska_krochmal, B., Dudek-Wicher, R. (2021) The Minimum Inhibitory Concentration of Antibiotics: Methods Interpretation and Clinical Relevance. Pathogens. www.mdpi.com/2076-0817/10/2/165
-
Ashour MB, Gee SJ, Hammock BD. Use of a 96-well microplate reader for measuring routine enzyme activities. Anal Biochem. 1987 Nov 1;166(2):353-60. doi: 10.1016/0003-2697(87)90585-9.
-
Tiwari S, Nizet O, Dillon N. Development of a high-throughput minimum inhibitory concentration (HT-MIC) testing workfl ow. Front Microbiol. 2023 May 25;14:1079033. doi: 10.3389/fmicb.2023.1079033.
-
How to optimize OD600 measurements, BMG LABTECH HowTo Note No.10, www.bmglabtech.com/en/howto-notes/how-to-optimise-od600-measurements/

广州进科驰安科技有限公司
Bio-Gene Technology Ltd.
热线:176 2009 3784
www.bio-gene.com.cn
marketing@bio-gene.com.cn
香港 北京 上海 广州









 药物筛选/分子生物学
药物筛选/分子生物学